イオン化エネルギー、電子親和力、電気陰性度という3つの言葉が教科書ではセットで出てきますが、説明できますか?今回はイオン化エネルギーについて解説します。基本を理解してしまえば頑張って覚えなくても問題を解けるようになります。
イオン化エネルギーとは「原子から電子を奪って陽イオンにするのに必要なエネルギー」と理解しましょう。この「必要な」の部分がミソで、イオン化エネルギーが大きいということは陽イオンにするのにたくさんのエネルギーが必要という意味なので、陽イオンになりにくいということになります。逆に、イオン化エネルギーが小さいということは陽イオンになりやすいということです。
では、どのような原子が陽イオンになりやすいのでしょうか。問題を解きながら考えてみましょう。
<問題>次の原子のうち、イオン化エネルギーの小さい(陽イオンになりやすい)方を選びなさい。
(1) Li, F (2) Li, Na
<解答>
(1) イオン化エネルギーを考える時は電子配置を考えると分かりやすいです。Liは最外殻のL殻に電子を1個持ち、Fは最外殻のL殻に電子を7個持ちます。陽イオンにするためには電子を1つ奪わないといけません。さて、どっちが奪いやすいでしょうか?正解はLiです。Liは電子を1つ奪えば最外殻がL殻から電子が2個のK殻に変わります。最外殻のK殻に電子が2個入った状態は非常に安定です。なのでLiの方が電子を奪いやすい=イオン化エネルギーが小さい=陽イオンになりやすいということになります。
(2) 先ほどと同様にして電子配置を考えてみましょう。LiはK殻に2個、L殻に1個の電子を持ちます。NaはK殻に2個、L殻に8個、M殻に1個の電子を持ちます。今度は両方とも最外殻に電子一つですね。どちらの電子が奪いやすいでしょうか?正解は、Naです。なぜならNaの方が原子半径が大きいので電子を引き付ける力が弱いからです。
以上、(1) (2)の説明から、イオン化エネルギーは周期表の右に行くほど大きく、下に行くほど小さくなることが分かります。つまり、周期表の左下にある原子ほどイオン化エネルギーが小さく、陽イオンになりやすいということになります。
少しややこしいかもしれませんが、ノートを見て確認してください。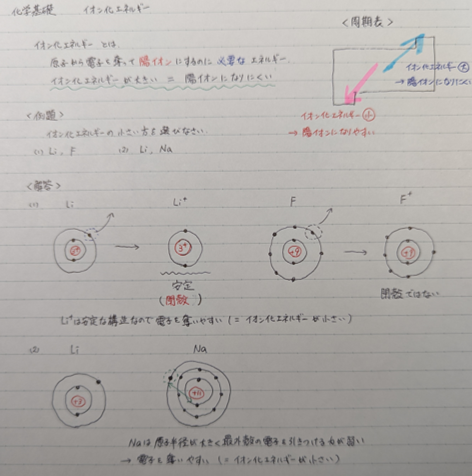

コメント